肿瘤放射治疗患者营养治疗指南(2022年)
更新时间:2023-06-30 编辑:管理员 浏览:1845
营养不良是肿瘤患者的常见临床表现,也是放射治疗(简称放疗)患者最常见的并发症之一。营养不良会对肿瘤患者的不良反应和放疗疗效造成不良的影响。因此,肿瘤放疗患者的营养治疗具有重要意义。基于此,中国抗癌协会肿瘤营养专业委员会、中华医学会放射肿瘤治疗学分会,中国医师协会放射肿瘤治疗医师分会组织专家制订了本指南,主要根据我国肿瘤放疗患者营养诊疗现状、国内外发表的循证医学证据,结合临床、营养、药学、护理等领域的专家经验和意见,采用欧洲心脏学会证据分级和推荐强度标准,围绕肿瘤放疗患者的放疗前、中、后不同阶段的营养评估、营养教育、营养途径和通路、营养素等提供指导。最终,制订了肿瘤放疗患者营养治疗指南,为临床医师规范化和标准化诊疗提供参考依据。
放射治疗(简称放疗)是恶性肿瘤最重要的根治手段之一,60%~80%的肿瘤患者在治疗过程中需要接受放疗[1]。营养不良是肿瘤患者的常见临床表现,也是放疗患者最常见的并发症之一。营养不良会对肿瘤患者的不良反应和放疗疗效造成不良的影响。因此,肿瘤放疗患者的营养治疗对具有重要意义[2-3]。但由于我国肿瘤放疗营养起步较晚,营养治疗一直以来被视为放疗的辅助手段,因此肿瘤放疗营养的临床和科研发展滞后于社会和患者的需求。近10年来,在国家的高度重视下,在肿瘤放疗营养专家的推动下,越来越多的放疗营养学者开始关注并逐步开展肿瘤放疗患者的营养治疗。我们相继发布了一系列放疗营养专家共识,包括《恶性肿瘤放疗患者肠内营养专家共识》《恶性肿瘤放疗患者营养治疗专家共识》等,一定程度上推动了我国肿瘤放疗营养的规范化。近年来,肿瘤放疗营养的临床研究和证据越来越多,有利于形成可执行的推荐意见,也为放疗营养指南的制定提供了文献基础。因此,本指南应运而生,主要就肿瘤放疗患者的营养治疗进行文献整理、证据级别分析以及专家共识推荐,希望为放射肿瘤医师、营养护士、临床营养师等开展营养治疗提供循证规范和决策参考。
本指南的总体目标是详尽收集肿瘤放疗患者营养治疗的有关证据,将已有证据和专家意见转化为诊疗建议,针对肿瘤放疗患者的营养诊断、营养途径、营养通路、营养方案等提供指导,以预防肿瘤放疗患者营养不良的发生,治疗已发生的营养不良,并以此增加肿瘤细胞的放射敏感性,提高放疗的精确性,减少放疗不良反应,进而增强放疗耐受性,提高放疗疗效和患者生存质量。
制订方法和流程
本指南中各部分内容由中国抗癌协会肿瘤营养专业委员会专家及其团队负责,成立工作小组后通过评估现有证据,制订推荐内容,并评估应用指南推荐引起的相关临床获益、成本和风险。实施步骤依照Delphi调查法,专家以证据级别为基础,根据其临床可行性、可及性等多方面考虑后进行相应推荐,是包含有专家主观意见的共识性建议。 本指南是一个基于系统性回顾与专家共识,并由多学科专家小组制订的指南。指南中证据分级和推荐强度标准依据欧洲心脏学会(European Society of Cardiology,ESC)标准制订,具体细则见表1和表2。本指南对中国知网、中国生物医学文献数据库、万方数据知识服务平台等国内核心数据库,以及PubMed、Embase、Google Scholar、Cochrane数据库等国际核心数据库进行了基于“肿瘤”“放疗”“营养”“Nutrition or malnutrition”“Cancer or tumor”“radiotherapy or radiation”等核心检索词/主题词的系统性文献检索。

放疗前指患者确定需要接受放疗但尚未开始放疗这一段时间。在放疗前,临床医师应根据患者营养筛查和营养评估结果,选择是否需要进行营养治疗,以及营养治疗和放射治疗的联合方式。对于营养状况良好的患者[患者提供的患者主观整体营养状况评估(scored patient-generated subjective global assessment,PG-SGA)=0~1分],可以直接进行放射治疗;可疑营养不良者(PG-SGA=2~3分),在营养教育的同时,实施放疗;中度营养不良者(PG-SGA=4~8分),在营养治疗的同时实施放疗;重度营养不良者(PG-SGA≥9分),需要先进行营养治疗1~2周然后重新评估,如果仍然属于重度营养不良,需要多学科讨论营养不良原因,给予相应指导和营养治疗后再评估;如果再次评估PG-SGA评分降到9分以下,可在营养治疗同时进行放疗[4],见图1。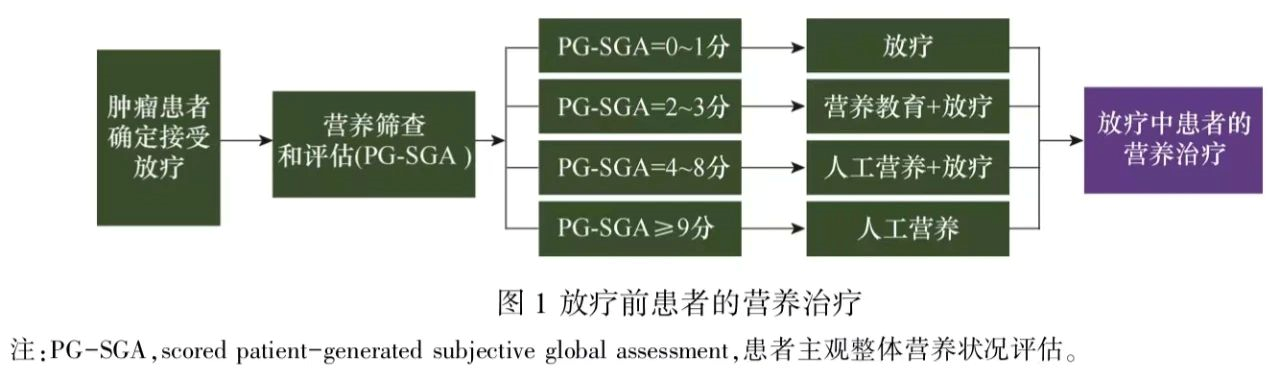
放疗前患者的营养教育需包括一般肿瘤患者的营养教育的基本内容,即回答患者及其家属提出的问题;告知营养诊断目的;完成饮食、营养与功能评价;查看实验室及器械检查结果;提出饮食、营养建议,破除营养误区;宣传肿瘤的病理生理知识;讨论个体化营养干预方案;告知营养干预可能遇到的问题及对策;预测营养干预效果;规划并实施营养随访。除此之外,还需要特别重视放疗患者营养教育的特殊性,在放疗前营养教育中需包括营养状况对放疗疗效和耐受性的影响、放射线对营养状况的影响、放疗前应该如何科学合理营养等方面的内容。 对于中-重度营养不良的患者(PG-SGA≥4分者),单纯的营养教育可能无法达到改善营养状况的效果,这类患者急需进行人工营养。人工营养首先要确定选择哪种营养治疗途径。由于患者尚未开始放疗,还没有放疗并发症的发生,因此其营养治疗途径的选择和一般肿瘤患者无差异,从五阶梯治疗原则的第二阶梯启动,然后依次向上晋级选择全肠内营养、部分肠内营养+部分肠外营养、全肠外营养[5]。当下一阶梯不能满足60%目标能量需求3~5d时,应该选择向上晋级一阶梯。 放疗前患者如果需要接受肠内营养治疗,一个有效、安全、方便而经济的肠内营养通路至关重要。肠内营养的通路主要包括口服和管饲。口服营养补充(oral nutritional supplement,ONS)可提供部分肠内营养(partial enteral nutrition,PEN)和全肠内营养(total enteral nutrition,TEN)。管饲是指通过置入营养管进行肠内营养的途径,包括经鼻胃/肠管(na-sogastric/nasointestinal tube,NGT/NIT)、经皮内镜下胃/空肠造瘘术(percustanous endoscopic gastrosto-my/jejunostomy,PEG/PEJ)和外科手术胃/空肠造瘘[6-8]。ONS接近于患者自然的进食过程,具有良好的依从性,是放疗前患者首选的营养治疗通路。当ONS不能满足目标需要量时,应该选择管饲[9-10]。在放疗前营养通路的选择上,除遵循一般原则外,还需要将放疗部位、放疗目的及预期治疗影响等因素作为重要的考量因素。 在放疗前是否需要常规预先置入营养管,目前还存在争议。对于绝大多数恶性肿瘤患者来说,放疗前常规预先置入营养管在改善患者营养状况和提高治疗疗效方面并没有优势,反而增加了患者的负担。但对于特殊部位的肿瘤或者在特殊的疾病状态下,如头颈部肿瘤或食管癌患者预期将发生严重放射性口腔或食管黏膜炎,可以考虑在放疗前给患者预防性置入肠内营养管,以保证患者在治疗过程中的营养状况良好和放疗的顺利进行[11-13]。 通常不推荐常规应用肠外营养,除非无法保证充足的口服/肠内营养,如严重吸收不良。肠外营养的通路主要包括周围静脉通路和中心静脉通路两大类。中心静脉导管通路包括经周围中心静脉导管(peripherally inserted central catheters,PICC)、经皮或隧道中心静脉导管(central venous catheter,CVC)、输液港等,按照穿刺部位又可以分为颈内静脉导管通路、锁骨下静脉导管通路、股静脉导管通路等。 肠外营养通路的选择首先应考虑肠外营养的预计持续时间和输注营养液的渗透压。周围静脉导管适用于短期肠外营养(<2周)和营养液渗透浓度低于900mmol/L H2O的患者。中心静脉导管适用于肠外营养超过2周和营养液渗透浓度高于900mmol/L H2O。除此之外,由于患者即将接受放射治疗,因此在肠外营养通路尤其是穿刺部位的选择上,应尽可能避开后续放疗的照射野,以减少放疗过程中和放疗后皮肤不良反应对肠外营养管的影响[14]。具体而言,放射线对肠外营养管的影响主要有以下两个方面:①放疗导致置管部位皮肤损伤,进而可能导致静脉置管部位水肿、感染、出血等不良反应,影响肠外营养的使用;②放射线照射营养管,影响营养管的质量和使用期限,甚至出现营养管断裂等严重不良反应。肠外营养置管部位选择的注意事项见表3。
(1)能量供给:放疗前患者营养治疗的目标能量的确定推荐参考间接能量测定法所获得的基础代谢能量水平,并结合患者的活动强度和疾病应激状况进行判断[15-16]。如果无法进行个体化的总能量消耗测量,建议每天应给予25~30kcal/kg的能量。非荷瘤状态下三大营养物质的供能比例为:碳水化合物50%~55%、脂肪25%~30%、蛋白质15%~20%。对于恶性肿瘤放疗前患者,建议适当减少碳水化合物在总能量中的供能比例,提高蛋白质和脂肪的供能比例。 (2)蛋白质供给:对于普通的放疗前患者,推荐的目标蛋白质量为1.2~1.5g/(kg·d),但对于特殊患者人群如并发恶液质的患者,由于骨骼肌质量持续下降,蛋白质及能量负平衡,因此应进一步提高蛋白质的摄入量,可达到2.0g/(kg·d)[17-18]。高剂量蛋白质供给时,要考虑患者的肝肾功能所能承受的程度。
放疗中患者的营养治疗
在放疗期间,急性放射损伤是影响患者营养物质摄入和营养状况的重要因素,是患者营养不良的危险因素。因此,建议对患者进行PG-SGA评分和急性放射损伤分级[美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)]的综合评估之后再进行合理、 规范的营养治疗。当患者PG-SGA评分或RTOG急性放射损伤分级达到治疗路径中相应的分数或分级时,则选择对应的治疗路径,参见图2。在放疗过程中,患者的营养状况和放射性损伤分级会不断发生变化,需要每周至少进行再评价1次,以便及时调整治疗方案和路径。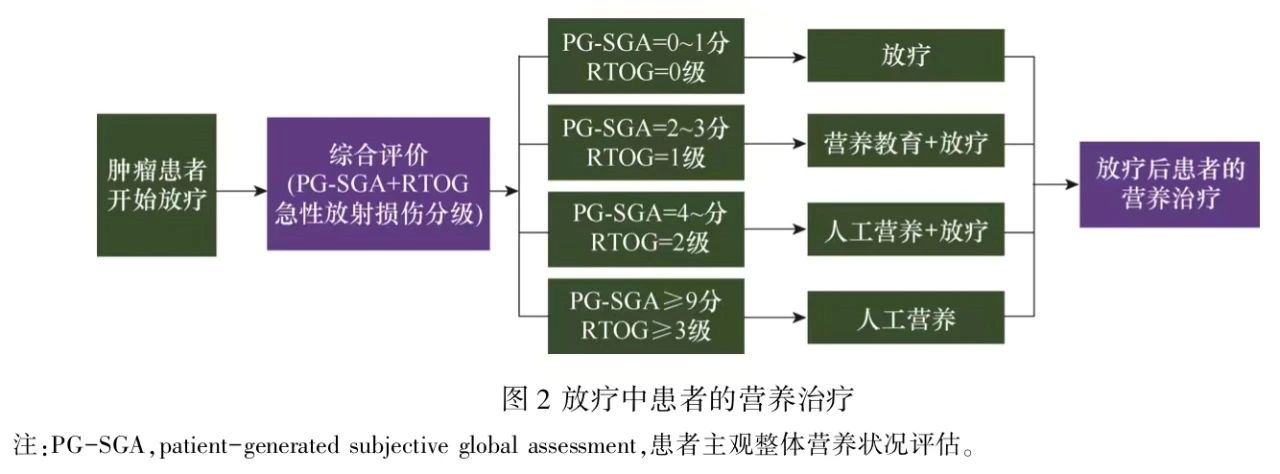
证据显示,对放疗中患者进行营养教育,可以培养患者良好的饮食习惯、增加患者营养摄入量、增加体重、改善生活质量、有效避免放射治疗的中断[19-22]。营养教育可以由临床医师、临床营养师、营养护士根据患者的营养需要和对影响营养摄入的问题进行分析和评估,指导患者摄入正常需要的食物,帮助患者改善进食,达到营养治疗的目的。由于放疗患者的特殊性,放疗中患者的营养教育重点是常见影响患者营养状况的急性放疗不良反应的预防和处理。 和放疗前患者一样,ONS仍是放疗中患者的首选营养治疗方式。证据表明,头颈部肿瘤、食管癌放疗患者,ONS可以有效地增强饮食摄入和增加患者体重[23-25]。一项前瞻性研究提示,局部晚期鼻咽癌患者预防性使用ONS不仅可以改善患者的营养不良,同时还可以提高患者对同步放化疗的耐受性[26]。对于ONS不能满足目标营养需求时应进行管饲营养。放疗前常规预先置入营养管并不能提高患者营养情况及减少放疗中断,反而会增加患者的负担[27],因此对于一般患者建议进行反应性营养置管,即在放疗过程中,根据患者的需要进行置管。PEG/PEJ和NGT是管饲的主要方法,两者在肠内营养的疗效上没有明显差异。相较于NGT,PEG/PEJ费用较高,会一定程度上影响患者的吞咽功能,影响放疗后患者正常饮食的恢复。对于肿瘤放疗患者应首选NGT,当NGT无法满足营养需求或者需长期人工喂养时才应考虑PEG/PEJ。而对于头颈部肿瘤或颈段食管癌患者,由于解剖位置的特殊性,易导致放射性口腔炎、黏膜炎等,需要长期人工喂养,且鼻饲管可能对鼻咽、口腔及食管黏膜造成一定的损伤,因此可以优先考虑PEG/PEJ进行营养治疗[28-29]。 放疗患者并不推荐常规使用肠外营养(parenteral nutrition,PN),但患者在放疗过程中发生严重放射性黏膜炎或者放射性肠炎时,或者EN不充分或不可实施时,应联合部分或全PN,以增加能量及蛋白质的摄入量,减少或避免负氮平衡和喂养不足的发生。《成人补充性肠外营养中国专家共识》推荐,对于NRS2002≥5分或危重患者营养风险评分(nutrition risk in the critically ill score,NUTRIC)≥6分的高风险患者,如果EN在48~72h无法达到目标能量和蛋白质需要量的60%时,推荐早期给予PN治疗。而对于NRS2002评分≤5分或NUTRIC≤6分的低风险患者,如果EN未能达到目标能量和蛋白质需要量的60%超过7d时,才启动补充性肠外营养(supplemental parenteral nutrition,SPN)治疗[30]。 肿瘤患者在放疗过程中对于能量的需求随着放疗的进行而不断变化。通常认为,在放疗中的1~3周,由于肿瘤负荷减少和高代谢状态的抑制,能量需求呈逐渐下降的趋势;而在放疗的第4周后,随着放疗不良反应的发生,能量需求则逐渐增加。因此,放疗中患者的目标能量摄入量需要根据肿瘤负荷、应激状态和急性放射损伤个体化给予并进行动态调整。 放射线对肿瘤患者蛋白质代谢具有负面影响,蛋白质对正常组织的放射性损伤修复也具有重要作用。因此,在肿瘤放疗过程中,尤其是发生放射性损伤后,高蛋白质营养[≥2.0g/(kg·d)]有助于缓解放射性损伤程度,加快损伤修复,改善营养状况,但最佳的目标蛋白质量仍不清楚。另外,如给予高蛋白营养,需要定期检测患者肝脏和肾脏功能情况。 (1)谷氨酰胺:谷氨酰胺是血液中最丰富的氨基酸之一,在维持黏膜完整性方面起着至关重要的作用,还可以通过其合成代谢作用和促进基质形成来促进伤口愈合,但其在肿瘤放疗过程中使用的价值和作用目前还存在争议。一项meta分析系统性评价了谷氨酰胺等膳食补充剂在预防或减轻盆腔放疗所致患者胃肠道毒性症状方面的疗效。该研究共纳入了23项随机对照试验(1919例患者),结果发现,谷氨酰胺补充对盆腔放疗所致的急性胃肠道症状包括腹泻、恶心、呕吐、胀气/腹胀、排便频率、里急后重和直肠出血等没有影响(RR=1.05,95%CI=0.86~1.29)[31]。EdaK等[32]纳入40例接受放疗的乳腺癌患者并随机分为两组。第1组中的患者采用谷氨酰胺治疗,而第2组中的患者用安慰剂治疗。结果发现,在谷氨酰胺治疗组88.9%的患者出现Ⅰ级放射性皮肤毒性,相比之下,安慰剂组80%的患者出现Ⅱ级毒性皮肤毒性,差异具有统计学意义(P<0.001)。研究者认为,谷氨酰胺具有减轻放射性皮炎的作用。Huang CJ等[33]的研究探讨了接受头颈部肿瘤放疗患者口服谷氨酰胺对急性放射性口腔黏膜炎的影响。该研究中,试验组患者从放疗前7d到放疗后14d,每天口服3次谷氨酰胺(5g谷氨酰胺和10g麦芽糊精),而对照组患者口服安慰剂(15g麦芽糊精)。研究结果发现,体质指数(body mass index,BMI)降低与接受放疗的头颈部肿瘤患者放射性口腔黏膜炎的严重程度密切相关,但与谷氨酰胺的使用无关。而另一项纳入6项随机对照试验共441例患者的meta分析同样发现,口服谷氨酰胺可能对预防或降低接受单独放疗或同时接受化疗的头颈部肿瘤患者的放射性口腔黏膜炎的发生率和严重程度没有益处[34]。因此,需要更严格的方法和更大规模的随机对照试验来进一步提高证据的质量。 (2)益生菌:益生菌可通过产生抗菌物质、与病原体竞争上皮黏附和营养、参与宿主的免疫调节、抑制细菌毒素的产生发挥有益作用。多项研究发现,益生菌可能有助于预防腹部或盆腔肿瘤患者在放疗期间的放射性毒性反应。一项随机对照临床研究纳入接受放疗的妇科肿瘤患者,随机分配为安慰剂组或低剂量益生菌(1×1010菌落形成单位/胶囊,每日2次)或高剂量益生菌(5×1010菌落形成单位/胶囊,每日2次)。益生菌口服时间为放疗开始前1周到放疗完成后2周。研究结果发现,益生菌的摄入是有益的,显著减少了妇科肿瘤患者的放射治疗不良反应,包括显著减少了大便次数>1次的平均天数[(8.65±5.93)d比(15.04±8.92)d]、腹痛和排便急迫等症状[35]。Liu MM等[36]对随机对照试验进行了荟萃分析,以评估补充益生菌预防放射性腹泻的疗效。该研究包括6项试验,共917例患者(其中490例患者接受预防性益生菌治疗,427例患者接受安慰剂治疗)。与安慰剂相比,益生菌与较低的放射性腹泻发病率相关。 (3)不饱和脂肪酸:ω-3多不饱和脂肪酸是一种长链、多不饱和脂肪酸,作为一种免疫营养素,被研究者用于改善放疗中患者的营养状况并调节放疗患者的全身炎症反应,但结果却存在争议。一项meta分析共纳入10项随机对照试验,合计486例患者。结果显示,两组患者放疗前后体重变化值、BMI变化值、总体不良反应发生率和厌食不良反应发生率比较差异均无统计学意义[37]。而另外一项meta分析共纳入10项随机对照试验,以探讨ω-3多不饱和脂肪酸对肺癌放化疗患者的影响。研究结果发现,ω-3多不饱和脂肪酸可以改善接受放疗和化疗的肺癌患者的营养状况(体重变化、白蛋白变化、能量摄入和蛋白质摄入)并调节炎症指标(CRP和TNF-α)[38]。
放疗后患者的营养治疗
营养评估是放疗后患者营养治疗的重要前提,有利于评价放疗中营养治疗的效果,及时发现和解决患者放疗后由于急性放射损伤所致的各种营养问题,见图3。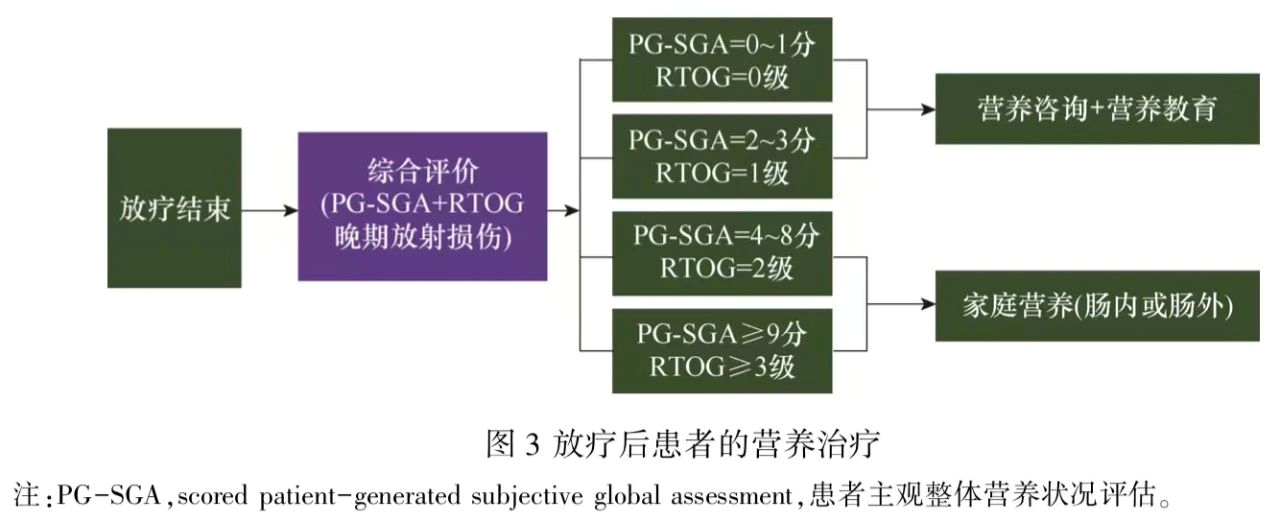
(1)评估内容:肿瘤患者放疗结束后,如因肿瘤未完全消退、放疗远期并发症如吞咽功能障碍、食管纤维化和狭窄等原因造成经口摄入营养仍不足,仍需要进行定期评估。评估内容需要综合评估PG-SGA评分和RTOG急性放射损伤分级标准。除此之外,还需要重点评估患者营养摄入量、体重变化、血红蛋白、前白蛋白、淋巴细胞握力等营养指标。 (2)评估形式:放疗后患者的营养评估形式包括电话、应用程序(application,APP)、门诊随诊、家等,其中APP随访是目前受患者及医务人员青睐的形式,也可通过微信进行咨询。放疗后的营养团队可以通过APP发布各种科普文章及营养活动通知等。目前国内已有多家医疗平台可以实现院后随访功能,医师或营养师可以根据个人需求进行选择。评估间隔时间应根据患者的临床情况来决定,开始营养治疗后1个月内1~2周随访1次,1个月以后1~3个月随访1次[39]。 放疗后患者的营养教育对于患者出院后体重、营养状况的维持具有重要意义。营养教育的内容重点要包括:放疗后患者和家属如何进行自我营养监测、常见的可能影响营养状况的远期放疗并发症的预防与处理、带肠内或肠外营养管出院患者的护理等[40]。 放疗后患者如需进行家庭营养治疗,需要专人记录家庭营养患者的基本资料,包括联系方式、营养筛查及评估、营养治疗方案、营养监测及随访记录等。ONS是放疗后患者家庭营养最主要的方式,是对患者经口摄入营养不足的重要补充。部分恶性肿瘤放疗患者出院后仍需要继续管饲肠内营养,对于营养管的管理则成为家庭营养的重要内容。Crombie JM等[41]的研究显示,头颈部肿瘤放疗过程中行PEG的患者,放疗后6个月内营养管拔除率为52%,1年拔除率为86%。有3%左右的头颈部放疗患者携带营养管长达3年,对于这部分患者家庭营养尤为重要。患者家庭营养治疗要求医师为患者选择和建立适宜的营养途径、制定营养方案、指导照护者监测营养并发症并对营养过程进行管理,以保证家庭营养治疗的有效性和安全性[42-43]。3.1 推荐在肿瘤患者放疗全程即放疗前、放疗中和放疗后,进行规范化的营养评估和营养治疗。(证据分级:A;推荐强度:Ⅰ)3.2 推荐在肿瘤患者放疗前采用PG-SGA量表进行营养评估,在放疗中联合PG-SGA量表和RTOG急性放射损伤分级进行营养评估,在放疗后联合PG-SGA量表和RTOG晚期放射损伤分级进行营养评估,并根据评估结果选择营养治疗和抗肿瘤治疗的联合模式。(证据分级:B;推荐强度:Ⅱa)3.3 营养教育可以让肿瘤放疗患者达到增加能量和营养素摄入的目的,建议放疗前、中、后均需开展,但需根据患者放疗的不同阶段个体化进行。(证据分级:B;推荐强度:Ⅰ)3.4 在放疗的各个阶段,肠内营养均是营养治疗的首选途径,不推荐常规进行肠外营养。当患者肠内营养无法实施或因严重放射性黏膜炎、放射性肠炎导致无法获得足够的营养需要时,推荐及时联合部分或全肠外营养。(证据分级:A;推荐强度:Ⅰ)3.5 肿瘤放疗在实施肠内营养时,ONS是首选,不推荐放疗前常规预防性置入营养管。需要管饲的放疗患者,如预计管饲营养时间短(≤30d),首先选择经鼻管饲(NGT),而需要长期管饲喂养(>30d)或头颈部肿瘤放疗患者,建议选择PEG/PEJ。(证据分级:B;推荐强度:Ⅱa)3.6 肿瘤放疗患者肠外营养通路的选择除需常规考虑预计持续时间和营养液的渗透压外,还需要考虑照射野的范围,应尽可能避开照射野,以减少放射线对肠外营养管的影响。(证据分级:B;推荐强度:Ⅱa)3.7 肿瘤放疗患者能量目标量推荐为25~30kcal/(kg·d)。在放疗过程中,患者能量需求受到肿瘤负荷、应激状态和急性放射损伤的影响而变化,因此需要个体化给予并进行动态调整。(证据分级:B;推荐强度:Ⅰ)3.8 肿瘤放疗患者推荐提高蛋白质摄入量。对于一般患者推荐1.2~1.5g/(kg·d),对于严重营养不良患者,推荐1.5~2.0g/(kg·d),而对于并发重度放射损伤或恶液质的患者可提高到2.0g/(kg·d),但需考虑患者的肝肾功能所能承受的程度。(证据分级:B;推荐强度:Ⅰ)3.9 在肿瘤放疗过程中,谷氨酰胺对降低放射性皮肤损伤的发生率和严重程度有益处,但对于放射性肠炎的预防和治疗作用缺乏足够的临床证据。(证据分级:A;推荐强度:Ⅱb)3.10 ω-3PUFA制剂可能对减少患者炎症反应,保持患者体重有益,但对放疗后肿瘤消退和患者生存时间的影响还缺乏高级别研究证据。(证据分级:A;推荐强度:Ⅱa)3.11 益生菌有助于预防腹部或盆腔肿瘤患者在放疗期间的放射性毒性反应。(证据分级:A;推荐强度:Ⅰ)3.12 肿瘤患者放疗后仍需定期进行营养监测和随访,对于存在营养不良的患者,建议给予家庭营养。患者家庭营养要求医师为患者选择和建立适宜的营养途径、制定营养方案、指导照护者监测营养并发症并对营养过程进行管理,以保证家庭营养治疗的有效性和安全性。(证据分级:B;推荐强度:Ⅱa)











